Hjem » Pulmonal patofysiologi » Hæmoglobin og iltbindingskurven
Hæmoglobin og iltbindingskurven
Hæmoglobin er et protein, der findes i erytrocytter, og nu skal det handle om dets struktur og funktion i relation til gastransport i blodet.
- Hæmoglobinstruktur
- Hæmoglobinindhold i blodet
- Iltbindingskurven (hæmoglobin-oxygen-dissociationskurven)
- Bohr-effekten
- Temperatur og iltbindingskurven
- 2,3-DPG og iltbindingskurven
.
Jeg havde engang en forelæser, der skulle fortælle om hæmoglobin, og han var svært begejstret for hæmoglobin: Prøv at forestille dig at have en hjælper, der både bragte mad ud, afleverede det præcis, hvor du havde brug for det, tog affald med tilbage og dumpede det samtidig med, at det hentede nyt mad? Og tænk hvis du havde 6,56 * 1021 af dem.
Det følgende bygger i vid udstrækning på Boron (2016), se kilde nedenfor.
Hæmoglobinstruktur
Hæmoglobin er et protein, der består af fire subunits og således et tetramer. Hvert subunit består af en molekylet hæm, der er en porfyrinring bundet til ét molekyle jern, og et globin, der enten er en α- eller en β-kæde.
Jern er enten som Fe2+ eller oxideret til Fe3+, og er jernet i det oxiderede stadie, kan hæmoglobin ikke binde oxygen, og i så fald kalder man et methæmoglobin.
Hæmoglobin findes i to forskellige tilstande: spændt og afslappet eller relaxed og tense. Ved lave ilttryk er hæmoglobin i sin tense-form og har lav affinitet for ilt. Ved højere ilttryk vil alle subunits efter binding af et eller flere iltmolekyler på et tidspunkt hoppe over i deres relaxed-form og mangefold øge iltaffiniteten. I et anfald af rent management-lingo har man fundet på at kalde den sammenhæng for positiv kooperativitet. Forskellen på iltaffiniteten i tense og relaxed-form er baggrunden for sigmoidforløbet af iltbindingskurven. Boron følger her “the concerted model” ifølge hvilken hele hæmoglobinet skifter tilstand med det samme; alternativt kan man lægge billet ind på “the sequential model” ifølge hvilken tilstandsskiftet sker kontinuerligt.
Hæmoglobinindhold i blodet
| Indhold i g/dL | Indhold i mmol/L | |
| Kvinder | 11,8 – 15,3 | 7,3 – 9,5 |
| Mænd | 13,4 – 16,9 | 8,3 – 10,5 |
Iltbindingskurven (hæmoglobin-oxygen-dissociationskurven)
Hæmoglobins iltbindingskurve beskriver sammenhængen imellem partialtrykket i (arterielt eller venøst) blod af oxygen og iltmætningen af hæmoglobin. Det vil sige, at den beskriver sammenhængende værdier af PO2 og SO2, sådan at der til ét ilttryk korresponderer én iltmætning. Mindre mundret kan iltbindingskurven også kaldes hæmoglobin-oxygen-dissociationskuren, fordi den beskriver, hvordan oxygen dissocierer fra hæmoglobin ved forskellige ilttryk. Som skrevet er iltbindingskurven sigmoid-formet som følge af hæmoglobins positive kooperativitet.
Man kan bruge gode mængder af tid på at lede efter faktiske data, sætte dem ind i excel og plotte dem i en graf. Man kan også tegne iltbindingskurven som koncept, men uden korrekte værdier. Man kan også copy-paste fra well-renowned og peer-reviewed kilder, men givet en del forlags anstrengte forhold til ophavsret, og den betragtelige tid, man kan bruge på at kontakte forlag via s100.copyright.com, og de excorbitante beløb, man af og til bliver afkrævet, er det for denne forfatter ikke en farbar vej. I stedet er herunder oxygens iltbindingskurve ved pH = 7,40 og temperatur på 37 grader celsius snuppet direkte fra Yartsev, with permission, og baseret på data fra Severinghaus (tabel 1, her)
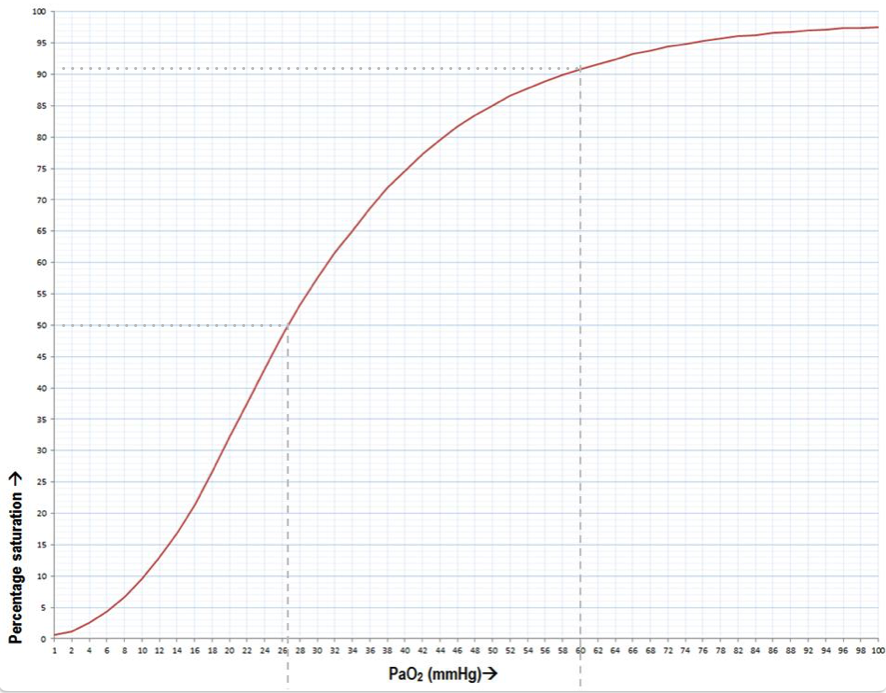
X-aksen ovenfor er begrænset til PaO2-intervallet imellem 1 og 100, og Y-aksen er selvfølgelig naturligt begrænset til 0 til 100 %. Sigmoidformen ses tydeligt, og havde man fortsat X-aksen ad inifinitum havde man nærmet sig, men aldrig nået en vandret kurve med en iltmætning på 100 %. For eksempel er et PaO2-tryk på 250 mmHg forbundet med en iltmætning på 99,41, mens en fordobling i i trykket til 500 mmHg kun er forbundet med en stigning til 99,72 % – 0,31 procentpoint.
Der er markeret to punkter på kurven.
1) Det første ud for 50 % iltmætning, der leder ned til et ilttryk på 26 mmHg. Det er værdien p50 og angiver det ilttryk, hvor 50 % af hæmoglobin er mættet med ilt. Man må bemærke, at iltmætningen stiger stejlt her, sådan at en relativt lille øgning i ilttrykket er forbundet med en markant øgning i iltmætningen – og derved en markant øgning i iltindholdet i blodet.
2) Det andet punkt er markeret ved 60 mmHg og korresponderer til en iltmætning på 91 %. Det er Yartsevs punkt, og jeg havde nok valgt at sætte det ved 72 mmHg svarende til 9,6 kPa og en iltmætning på 94 %; en typisk grænse for hypoxæmi.
Forskydninger i iltbindingskurven
Iltbindingskurven er ikke en statisk størrelse, men forandrer sig med ændringer i det omgivende miljø: Stigninger i CO2-tryk og fald i pH højreforskyder kurven, det gør også temperaturstigninger og stigninger i det glykolytiske biprodukt 2,3-DPG.
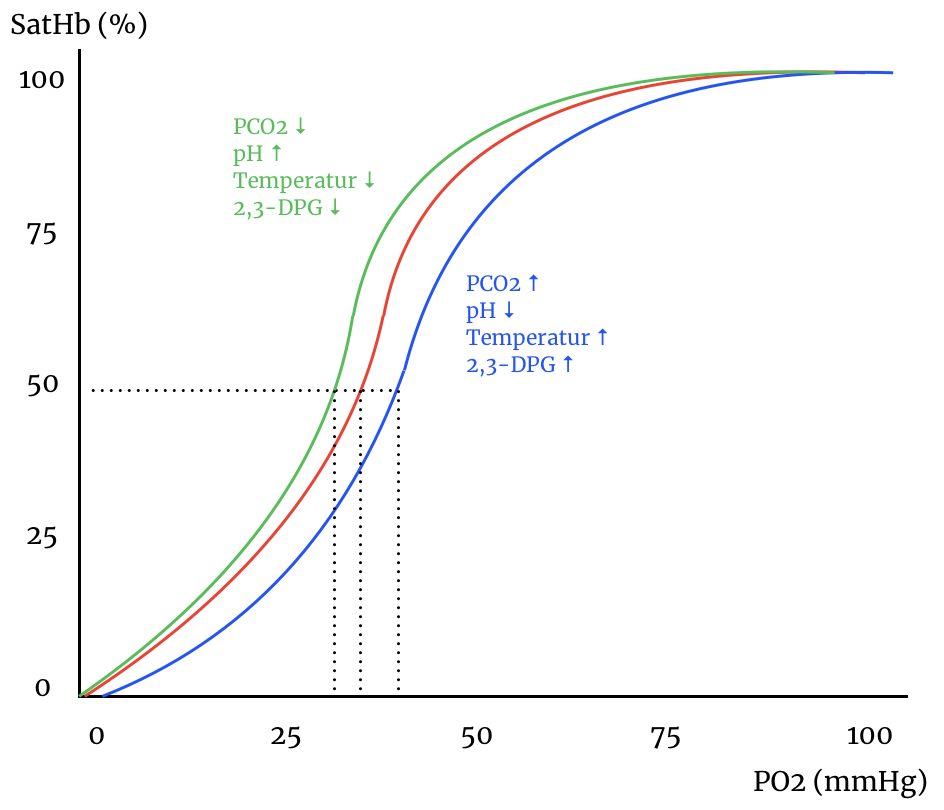
Min graftegningsevner – og mine værktøjer til det – er begrænsede, så værdierne på akserne er mere eller mindre arbritrære, og kurven er nok heller ikke helt empirisk korrekt. Læg ikke for meget i det. Men ovenstående farveladefigur skulle gerne illustrere højre- og venstreforskudte dissociationskurver. Den røde kurve er dissociationskurven under standardbetingelser, mens den blå og grønne kurve er dissociationskurven under påvirkning af omgivelserne. Nedenfor går jeg marginalt mere i dybden med effekterne. Jeg har indført p50 værdier: Det er den stiplede linje der går fra 50 %’s iltmættede hæmoglobin. Fra den stiplede vandrette linje går tre stiplede lodrette linjer som angiver det ilttryk, hvor iltmætningen netop er 50 %. Som man kan se, varierer det tryk med omgivelserne.
Bohr-effekten
Bohr-effekten (nej ikke den Bohr, heller ikke den Bohr eller den Bohr men denne Bohr) siger, at acidose og øget pCO2 forskyder iltbindingskurven til højre, mens alkalose og nedsat pCO2 forskyder den til venstre.
Det betyder, at ilt i sure miljøer nemmere dissocierer fra hæmoglobin. Der skal simpelthen et højere ilttryk til for at mætte den samme andel hæmoglobin som i et neutralt miljø. Omvendt i basiske miljøer – her vil ilt nemmere binde til sig hæmoglobin.
Effekten er smart: En hårdt arbejdende muskels vaskulatur vasodilaterer for at øge blodtilførslen. Hårdt arbejdende muskler producerer også sure miljøer, og i lokale sure miljøer vil ilt derfor lettere kunne frigives og indgå i respirationskæden.
Man skelner imellem to selvstændige Bohr-effekter (pH- og CO2-effekten), fordi der sker forskydninger af iltbindingskurven når den ene holdes konstant, og den anden ændres og omvendt. I tilfældet respiratorisk acidose, som var det Bohr oprindeligt undersøgte, er bevægelsen selvfølgelig samtidig i begge parametre: Respiratorisk acidose, det vil sige faldende pH, er netop forårsaget af stigende pCO2.
Temperatur og iltbindingskurven
En stigende temperatur (igen for eksempel i en arbejdende muskel) giver en højreforskydning af iltbindingskurven og derved samme effekt som faldende pH og stigende pCO2. Boron (2016). Omvendt gælder det for faldende temperaturer.
2,3-DPG og iltbindingskurven
2,3-DPG (2,3-diphosphoglycerat) er en glukolytisk metabolit, der findes i høje koncentrationer i erytrocytter, og hvis koncentration stiger, når PO2 falder. Hæmoglobin i dens tense-form har en høj affinitet for 2,3-DPG, og når 2,3-DPG binder til hæmoglobin, stabiliseres tense-formen betragteligt og resterende O2-molekyler dissocierer fra hæmoglobin.
Det betyder, at høje koncentrationer af 2,3-DPG giver en højreforskydning af iltbindingskurven, mens lave koncentrationer giver en venstreforskydninger. Kliniske situationer med kronisk hypoxi, fx KOL, anæmi og ophold i højderne, er forbundet med øgede koncentrationer af 2,3-DPG.
Kilder
De fleste lærebøger i medicinsk fysiologi kan formentlig være en hjælp for dig her. Jeg går altid til Boron & Boulpaep, der også er den primære kilde til ovenstående. Således:
Boron WF (2016). Ch 29 Transport of oxygen and carbon dioxide in the blood. I Boron WF & Boulpaep EL Medical Physiology 3rd Ed. Elsevier, pp.: 647-659.
Figuren er taget fra Yartsev A (2015). The oxyhaemoglobin dissociation curve. På DerangedPhysiology.com. Tilgået d. 30/5-2024.
Har du kommentarer, er du meget velkommen til at sende dem ind her: