Hjem » Pulmonal patofysiologi » Tryk, partialtryk og gasser opløselighed
Gastryk, partialtryk og gassers opløselighed
Givet at det for mange er svært at gå på arbejde uden at møde enten et iltudtag i væggen, skulle aflæse en for for blodgasanalyse eller forholde sig til gas i den ene eller anden form, er det rimeligt at orientere sig lidt i den klassiske fysiks gaslove. Så her følger om:
- Gasser og gastryk
- Partialtryk og Daltons lov
- Gassers opløseligehed og Henrys lov
Gasser og gastryk
Et eller andet sted sidder der en fysiker og har tænkt langt og grundigt over, hvad der egentlig konstituerer en gas. Et lægmands (og her kvalificerer en simpel uddannelse i medicin ikke til at være andet end lægmand) kunne måske sige noget i retning af, at en gas består af hastigt vibrerende partikler adskilt af stor afstand i et volumen. Og bare ved at sige det, har undertegnede lægmand måtte læne sig op ad Purdue, der har denne fantastiske GIF-side.
Fordi de vibrerende partikler konstant banker imod enten volumens afgrænsning eller en eller anden given membran, man plopper ned i volumen, genererer de et tryk. Det viser sig, at under ideelle omstændigheder er produktet af tryk og volumen er proportionelt med produktet af antallet af gasmolekyler, temperaturen og en konstant. Det kan man udtrykke sådan her:

Gastryk og enheder
| Enhed | Atmosfærisk luft (0 grader, 1 m.o.h.) | Partialtryk af O2 i arterielt blod | Partialtryk af CO2 i arterielt blod |
| Kilopascal (kPa) | 101,325 | 12,8 | 4,7 |
| Millimeter kviksølv (mmHg) | 760 | 96 | 35,3 |
| Centimeter vand (cmH2O) | 1033,2 | 130,5 | 49,9 |
| Atmosfæres tryk (atm) | 1 | 0,126 | 0,046 |
| Bar (bar) | 1 | 0,128 | 0,047 |
Partialtryk og Daltons lov
Mange gasser består af flere forskellige typer af partikler. Stating the obvious består atmosfærisk gas af primært nitrogen og oxygen, mens alveolære gasser primært består af nitrogen, oxygen og kuldioxid. Gastrykket er det samlede tryk, som de enkelte gasser tilsammen udøver.
I klinikken er man interesseret i enkelte gassers tryk eller med andre ord partialtrykket. Det viser sig, at det totale tryk af en gas udgøres af det tryk, som de enkelte konstituerende gasser i sig selv præsterer. En afart af den formulering tilskrives den engelske fysiker John Dalton, og deraf hedder den Daltons lov.
Man kan illustrere situationen sådan her:
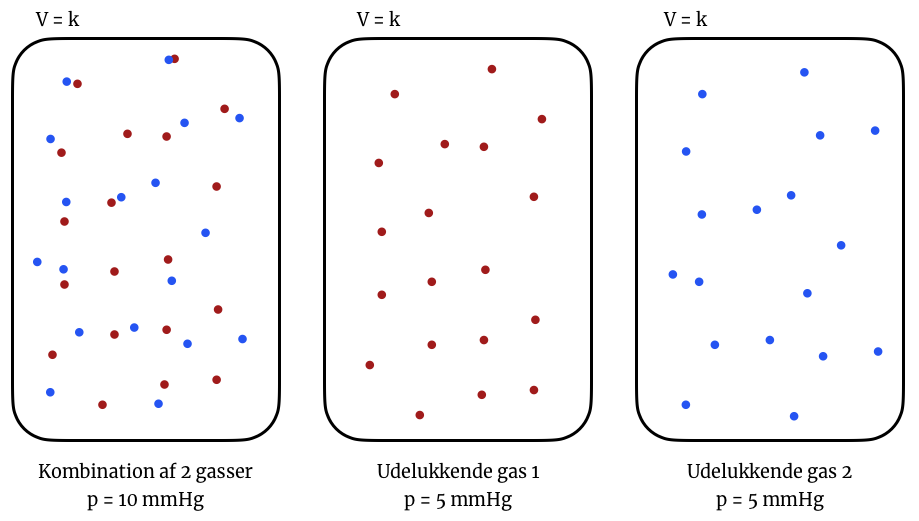
Første container indeholder 2 gasser med det samme antal gasmolekyler og har et samlet tryk på 10 mmHg. Hvis man forestillede sig, at man skilte de to gasser ad i to separate containere med samme volumina som det oprindelige, så ville trykkene i de to nye containere være 5 mmHg. Partialtrykket af gas 1 og gas 2 i den oprindelige container er derfor også 5 mmHg.
Gassers opløselighed og Henrys lov
Gasser kan opløses i væsker, og Henrys lov siger, at opløsningen af en gas i en væskefase i kontakt med en gasfase er proportionel med partialtrykket af den gas i gasfasen. Proportionalitetskonstanten angiver gassens evne til opløsning og kan kaldes Henrys konstant eller gassens solubilitet.

Loven stiger at koncentrationen af gas opløst i en væske er ligefremt proportionel med partialtrykket af gassen, Pa, og proportionalitetskonstanten kH.
For oxygen er konstanten 0,0013 mM/Pa og for kuldioxid 0,034 mM/Pa begge i vand og ved 25 grader celsius. Konstanten er afhængig af temperatur, sådan at gasser har nemmere ved at opløse sig i kolde væsker end i varme væsker. Konstanten afhænger også af opløsningen.
Partialtryk af en gas i en væske
En gas opløst i en væske udøver ikke et gastryk, så hvordan kan man så tale om partialtryk af gas i væske? Det kan man, fordi man med partialtrykket af gas i en væske i virkeligheden taler om partialtrykket af en gas, der var i ækvillibrium med en væske, hvori gassen var opløst. Man kan forestille sig, at man havde en væske med rigeligt opløst gas, som man udsatte for et vakuum. Den opløste gas vil altid være i et proportionalitetsforhold med gasfasen (det er dét, Henrys lov siger), og derfor vil den ækvillibrere med det (nu tidligere) gastomme rum. Det tryk, man kan måle i det her (nu tidligere) gastomme rum, er partialtrykket af gassen i væsken.
Kilder
Gupta B . Gasses and Vapour. UpdateInAnaesthesia.com. Kan findes på linket her. Tilgået d. 28/5-2024
R. Sander: Compilation of Henry’s law constants (version 5.0.0) for water as solvent, Atmos. Chem. Phys., 23, 10901-12440 (2023). doi:10.5194/acp-23-10901-2023
Yartsev A (2015). Partial pressure and the solubility of gases i biological systems. På DerangedPhysiology.com. Tilgået d. 28/5-2024.
Har du kommentarer, er du meget velkommen til at sende dem ind her: